قانون شارل در واقع اثبات می کند که در فشار ثابت، حجم گاز متناسب با دمای مطلق آن افزایش یا کاهش پیدا می کند. این اصل و قانون مهم، نقش مهمی در شناخت رفتار گازها دارد و منشا پیدایش قانون شارل از دانشمندی به نام ژاک شارل آغاز شد. علاوه بر آن قانون شارل از مهم ترین قوانین مباحث نظری شیمی و فیزیک بشمار می رود که در پدیده های عینی پیرامون ما از تغییر حجم بادکنک ها تا پرواز بالن های هوای گرم نقش بسیار موثری دارد. این قانون به طور مفصل توسط معلم خصوصی فیزیک در تهران آموزش داده می شود و در صورتی که سوالی در این زمینه داشته باشید می توانید آن را از دبیر بپرسید. در ادامه این مقاله با بررسی نمودار قانون شارل و بیان مثال های متعدد در زمینه قانون شارل به شما کمک می کنیم تا این قانون و مبحث را به خوبی بیاموزید. تا انتهای این مطلب همراه ما باشید.

قانون شارل چیست؟
قانون شارل که با نام قانون حجم ها نیز شناخته می شود، یک قانون آزمایشگاهی است که چگونگی انبساط گازها بر اثر گرما را بیان می کند. به عبارت دیگر زمانی که فشار یک نمونه از گاز خشک، ثابت نگهداشته شود، دمای کلوین و حجم با یکدیگر نسبت مستقیم خواهند داشت. این ارتباط را میتوان به صورت زیر نوشت:
V∝T
V=kT یاV / T = k
در رابطه بالا T دمای گاز بر اساس کلوین، V حجم گاز و k یک ثابت است. این قانون بیان میکند که چطور یک گاز با افزایش دما انبساط مییابد. به طور عکس، کاهش دما موجب کاهش حجم نیز خواهد بود. برای مقایسه یک ماده در دو حالت مختلف، این قانون را میتوان به شکل زیر بازنویسی کرد:
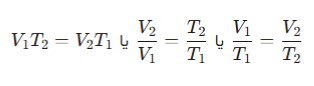
منشاء قانون شارل
منشاء قانون شارل براساس زحمات ارزشمند دانشمند فرانسوی ژاک شارل (Jacques Charles) است. ژاک شارل هیچ وقت کارهای آزمایشگاهی خود را به ثبت نرساند و اولین یا آخرین شخصی هم نبود که این پدیده را کشف کرد.
«آمونتوس» (Amontos) صد سال قبل از شارل آزمایشاتی را در این زمینه انجام داده بود و ژوزف گیلوساک» (Joseph Gay-Lussac) در سال 1808 نتایج معتبری را در مقالات جهانی به چاپ رساند که نشان می داد همه گازها از قانون حجم ها تبعیت می کنند.
ماکسول در سال 1860 طبق تحقیقاتی که انجام داد با اطمینان این موضوع را بیان کرد که فضایی که یک گاز اشغال می کند به طور خالص به حرکت مولکول های آن مرتبط است. در شرایط عادی، مولکول های گاز از یکدیگر فاصله دارند و این مولکول ها آنقدر کوچک هستند که حجم آنها نادیده گرفته می شود.
آزمایش قانون شارل
آزمایش قانون شارل بسیار ساده است. به عنوان مثال بادکنکی را در نظر بگیرید که در دمای اتاق از هوا پر شده باشد. اگر همان بادکنک را در مجاورت یک منبع گرما مانند نور خورشید یا بخاری قرار دهیم، پس از مدتی مشاهده میکنیم که حجم بادکنک افزایش مییابد، بدون آنکه گاز جدیدی وارد آن شده باشد.
علت این پدیده آن است که با افزایش دما، انرژی جنبشی مولکولهای گاز درون بادکنک بیشتر میشود. در نتیجه، تعداد و شدت برخورد مولکولها با دیواره بادکنک افزایش پیدا می کند. این افزایش برخوردها دو حالت را به دنبال دارد:
- اگر دیواره ظرف انعطافپذیر باشد (مانند بادکنک)، حجم آن افزایش مییابد تا فشار داخلی ثابت بماند.
- اگر دیواره ظرف سخت و غیرقابل تغییر باشد (مانند یک بطری شیشهای دربسته)، فشار گاز درون ظرف افزایش خواهد یافت.
از این مثال میتوان نتیجه گرفت که در شرایط فشار ثابت، میان حجم گاز و دمای مطلق آن رابطهای مستقیم برقرار است. این همان اصل اساسی قانون شارل است.
نمودار قانون شارل
نمودار قانون شارل که بیانگر همان قانون v=kt است، نشان می دهد که این رابطه یک معادله با شیب خط ثابت است. از این رو با رسم نمودار v در برابر t یک خط راست با شیبی برابر k خواهیم داشت.
.jpg)
در واقع این نمودار از مبدا می گذرد که یعنی اگر دمای مطلق گاز به صفر برسد، حجم آن نیز به صفر می رسد. همچنین زمانی که یک گاز را به شدت سرد کنیم؛ قبل از اینکه حجم آن به صفر برسد، مولکول های گاز بر اثر تراکم به مایع تبدیل خواهند شد.
این دما که در آن تغییرات فاز از گاز به مایع را داریم، برای گازهای مختلف، متغیر است. توجه داشته باشید که تمامی روابط ذکر شده برای قانون شارل را باید بر اساس دمای کلوین در نظر بگیرید و استفاده از این روابط با درجه سلسیوس عملی نیست. برای مثال فرض کنید که در شرایط فشار ثابت، حجم یک گاز برابر است با (V_1 = 2.00 ext{L}) در دمای (T_1 = 27^circ ext{C}). میخواهیم حجم را در دمای (T_2 = 177^circ ext{C}) پیدا کنیم و سپس چند نقطه برای ترسیم نمودار (V) برحسب (T) (در کلوین) آماده کنیم. برای پاسخ به این سوال باید سه مرحله را طی کرد.
قدم ۱ — تبدیل دما به کلوین
T(K) = T(°C) + 273.15
T1 = 27 + 273.15 = 300 K
T2 = 177 + 273.15 = 450 K
قدم ۲ — استفاده از قانون شارل
فرمول:
V1 / T1 = V2 / T2
یا:
V2 = V1 × (T2 / T1)
جایگذاری:
V2 = 2.00 × (450 / 300)
450 ÷ 300 = 1.5
پس:
V2 = 2.00 × 1.5 = 3.00 L
قدم ۳ — ثابت تناسب k
k = V / T
k = 2.00 / 300 = 0.00667 L/K
کنترل:
V2 = k × T2 = 0.00667 × 450 = 3.00 L
جدول دادهها برای نمودار V–T
|
نقطه |
دما(k) T |
حجم (L)V |
توضیحات تکمیلی |
|
1 |
200 |
1.333 |
حالت سردتر |
|
2 |
300 |
2.000 |
حالت اولیه |
|
3 |
400 |
2.667 |
گرم تر |
|
4 |
450 |
3.000 |
حالت مسئله |
در این مثال، افزایش دما از 300 K به 450 K (1.5 برابر) باعث شد حجم نیز از 2.00 L به 3.00 L (1.5 برابر) برسد. این نتیجه دقیقاً مطابق پیشبینی قانون شارل است.
کاربردهای قانون شارل
کاربردهای قانون شارل در مشاغل و اشیاء مختلفی مشاهده شده است که از مهم ترین کاربردهای قانون شارل می توان به موارد زیر اشاره کرد:
- گاز بادکنک های هلیومی
- نانوایی
- بالون هوای گرم
- اسپری های خوشبو کننده
- تایرخودروها
- موتور اتومبیل ها
بیشتر بخوانید:بهترین روش مطالعه و خواندن شیمی برای امتحان
محدودیت های قانون شارل
محدودیت های قانون شارل می تواند در انجام آزمایشات یا فرآیندهای تحقیقاتی مشکلات و چالش هایی را برای دانشمندان به وجود بیاورد. با این حال، قانون شارل بر پایهی مدل گاز ایدهآل تدوین شده است. در این مدل فرض میشود که مولکولهای گاز حجمی ندارند و هیچ گونه نیروی جذبی یا دافعی بین آنها وجود ندارد؛ اما در دنیای واقعی، این فرضیات همیشه برقرار نیستند؛ بنابراین قانون شارل در تمام موقیعت ها، قطعیت ندارد. در ادامه به بررسی مهم ترین محدودیت های قانون شارل خواهیم پرداخت.
انحراف گازهای واقعی از رفتار ایده آل
- در فشارهای بسیار بالا، فاصلهی میان مولکولها کم میشود و نیروهای بینمولکولی اهمیت پیدا میکنند. در نتیجه، حجم واقعی کمتر از مقدار پیشبینیشده خواهد بود.
- در دمای بسیار پایین، نزدیک به نقطهی مایعشدن مولکولهای دیگر آزادانه حرکت نمیکنند و قانون شارل برقرار نمیماند.
لزوم استفاده از دمای مطلق (کلوین)
قانون شارل فقط زمانی معتبر است که دما بر حسب کلوین بیان شود. اگر از سانتیگراد استفاده شود، رابطه خطی بهدرستی دیده نخواهد شد.
ثابت بودن فشار
این قانون فقط در شرایط فشار ثابت برقرار است. اگر فشار تغییر کند، باید از قانون گاز عمومی یا معادله حالت گازها استفاده کرد.
گازهای چند اتمی
برای گازهایی که ساختار مولکولی پیچیدهتری دارند، تغییرات انرژی جنبشی تنها عامل تغییر حجم نیست و انحراف از حالت ایدهآل بیشتر میشود.
سخن آخر
در نهایت باید گفت که قانون شارل یک تقریب مناسب برای گازهای رقیق در فشار کم و دمای معمولی است. با این حال برای شرایط خاص که فشار بالایی وجود دارد یا دمای نزدیک به مایع شدن گاز اتفاق می افتد، باید حتما از قوانین دقیق تری از جمله معادله واندروالس استفاده کرد تا نتیجه نهایی مسرت بخش باشد.



